- Estudio de los CDC sobre el control de la seguridad de una dosis adicional de la vacuna COVID-19
- Lo que ya se sabe sobre the vacuna de refuerzo?
- Entre los 306 participantes del ensayo clínico Pfizer-BioNTech, las reacciones adversas después de la dosis 3 fueron similares a las de la dosis 2.
Qué agrega este informe en la toma número 3 lanzada por los CDC hoy?
Entre el 12 de agosto y el 19 de septiembre de 2021, entre 12,591 personas registradas con v-safe que completaron una encuesta de control de salud después de las 3 dosis de una vacuna de ARNm COVID-19, el 79.4% y el 74.1% informaron reacciones locales o sistémicas, respectivamente, después de la tercera dosis; El 77.6% y el 76.5% informaron reacciones locales o sistémicas después de la segunda dosis, respectivamente.
¿Cuáles son las implicaciones para la práctica de la salud pública?
Los informes voluntarios de v-safe no encontraron patrones inesperados de reacciones adversas después de una dosis adicional de la vacuna COVID-19. Los CDC continuarán monitoreando la seguridad de la vacuna, incluso para dosis adicionales de COVID-19.
El 12 de agosto de 2021, la Administración de Alimentos y Medicamentos (FDA) enmendó las Autorizaciones de uso de emergencia (EUA) para las vacunas Pfizer-BioNTech y Moderna COVID-19 para autorizar la administración de una dosis adicional después de completar una serie de vacunación primaria a personas elegibles con condiciones inmunodeficientes moderadas a graves (1,2). El 22 de septiembre de 2021, la FDA autorizó una dosis adicional de la vacuna Pfizer-BioNTech ≥6 meses después de completar la serie primaria en personas ≥65 años, con alto riesgo de COVID-19 grave, o cuya exposición ocupacional o institucional las pone en alto riesgo de COVID-19 (1). Los resultados de un ensayo clínico de fase 3 realizado por Pfizer-BioNTech que incluyó a 306 personas de 18 a 55 años mostraron que las reacciones adversas después de recibir una tercera dosis administrada de 5 a 8 meses después de completar una serie de vacunación primaria de ARNm de 2 dosis fueron similares a los notificados después de recibir la dosis 2; Estas reacciones adversas incluyeron reacciones sistémicas y en el lugar de la inyección de leves a moderadas (3). Los CDC desarrollaron v-safe, un sistema voluntario de vigilancia de seguridad basado en teléfonos inteligentes, para proporcionar información sobre reacciones adversas después de la vacunación COVID-19.
Coincidiendo con la autorización de una dosis adicional para personas con condiciones inmunocomprometidas, la plataforma v-safe se actualizó para permitir que los solicitantes de registro ingresen información sobre las dosis adicionales de la vacuna COVID-19 recibidas. Entre el 12 de agosto y el 19 de septiembre de 2021, un total de 22,191 solicitantes de registro v-safe informaron haber recibido una dosis adicional de la vacuna COVID-19. La mayoría (97.6%) informó una serie de vacunación primaria de ARNm de 2 dosis seguida de una tercera dosis de la misma vacuna. Entre los que completaron una encuesta de control de salud para las 3 dosis (12,591; 58.1%), el 79.4% y el 74.1% informaron reacciones locales o sistémicas, respectivamente, después de la dosis 3, en comparación con el 77.6% y el 76.5% que informaron reacciones locales o sistémicas. reacciones, respectivamente, después de la dosis 2. Estos hallazgos iniciales no indican patrones inesperados de reacciones adversas después de una dosis adicional de la vacuna COVID-19; la mayoría de estas reacciones adversas fueron leves o moderadas. Los CDC continuarán monitoreando la seguridad de las vacunas, incluida la seguridad de dosis adicionales de la vacuna COVID-19, y proporcionarán datos para guiar las recomendaciones de vacunas y proteger la salud pública.
V-safe es un sistema voluntario de vigilancia de seguridad de EE. UU. Basado en teléfonos inteligentes; Las personas vacunadas elegibles para recibir un producto de vacuna autorizado o con licencia pueden registrarse en v-safe. La plataforma v-safe permite a los registrantes existentes informar que recibieron una dosis adicional de la vacuna COVID-19 y a los nuevos registrantes ingresar información sobre todas las dosis de la vacuna COVID-19 recibidas. Las encuestas de salud V-safe se envían durante los días 0 a 7 después de cada dosis de vacuna e incluyen preguntas sobre el lugar de inyección local y las reacciones sistémicas y los impactos en la salud. * Las encuestas se envían para la dosis más reciente ingresada.† Los miembros del personal del Sistema de Notificación de Eventos Adversos a las Vacunas (VAERS) se comunican con los solicitantes de registro que indican que se buscó atención médica después de la vacunación y alientan o facilitan la realización de un informe del VAERS, si está indicado.§
Entre los solicitantes de registro v-safe que informaron haber recibido una dosis adicional de vacuna COVID-19 entre el 12 de agosto y el 19 de septiembre de 2021, los datos demográficos, las reacciones locales y sistémicas y los impactos en la salud notificados durante los días 0 a 7 se describieron por patrón de vacunación (es decir, , fabricante de la vacuna recibida para cada dosis). Las personas que informaron haber recibido una serie primaria de diferentes fabricantes o un fabricante desconocido o no disponible en los Estados Unidos, o 2 dosis de vacuna después de recibir una vacuna de dosis única de Janssen (Johnson & Johnson) (150) fueron excluidas del análisis. de reacciones adversas después de recibir la dosis adicional.
El tiempo transcurrido desde la finalización de la serie de vacunación primaria hasta la recepción de una dosis adicional se describió mediante el patrón de vacunación. Se compararon los perfiles de eventos adversos después de las dosis 2 y 3 para los solicitantes de registro que recibieron la vacuna de ARNm del mismo fabricante para las 3 dosis.¶ Se utilizó el software SAS (versión 9.4; SAS Institute) para realizar todos los análisis. Estas actividades de vigilancia fueron revisadas por los CDC y se llevaron a cabo de acuerdo con la ley federal aplicable y la política de los CDC. **
Entre el 12 de agosto y el 19 de septiembre de 2021, un total de 22,191 personas que se registraron v-safe informaron haber recibido una dosis adicional de la vacuna COVID-19 después de completar la serie primaria (Tabla 1). Entre ellos, 14,048 (63.3%) eran mujeres y aproximadamente el 30% tenían entre 18 y 49, 50 y 64 años y entre 65 y 74 años.
La mayoría de los solicitantes de registro (21,662; 97.6%) informaron que recibieron una tercera dosis del mismo fabricante que su serie de vacunas de ARNm primaria, incluido el 98.6% de los receptores de Moderna y el 98.2% de los receptores de Pfizer-BioNTech. Pocos solicitantes de registro (341; 1.5%) informaron una serie de vacunas de ARNm primaria seguida de una dosis adicional de vacuna de ARNm de un fabricante diferente, una dosis de vacuna de Janssen después de recibir una serie de vacunas de ARNm primario (10; 0.05%) o una vacuna adicional. dosis de la vacuna COVID-19 de cualquier fabricante después de la vacuna Janssen (178; 0.8%).
Entre los 22,191 solicitantes de registro v-safe, el intervalo medio desde la finalización de la serie de vacunación primaria COVID-19 hasta la recepción de una dosis adicional fue de 182 días (rango intercuartílico [IQR] = 160-202 días) (Tabla 2). Entre los que recibieron 2 dosis de la vacuna Janssen, el intervalo medio entre dosis fue más corto (84 días; IQR = 16-136 días).
Las reacciones locales (16,615; 74.9%) y sistémicas (15,503; 69.9%) se notificaron con frecuencia durante la semana posterior a una dosis adicional de la vacuna COVID-19, con mayor frecuencia el día después de la vacunación. Las reacciones notificadas con frecuencia fueron dolor en el lugar de la inyección (15,761; 71.0%), fatiga (12,429; 56.0%) y dolor de cabeza (9,636; 43.4%).
Entre 22,191 receptores de dosis adicionales, un total de 7,067 (31.8%) informaron impactos en la salud y aproximadamente el 28.3% (6,287) informaron que no podían realizar sus actividades diarias normales, más comúnmente el día después de la vacunación. 401 (1.8%) solicitantes de registro solicitaron atención médica y trece (0.1%) fueron hospitalizados. Las razones para recibir atención médica u hospitalización no se identificaron en la encuesta de v-safe; sin embargo, el personal del VAERS se comunicará con los solicitantes de registro que indiquen que se buscó atención médica después de la vacunación y se les animará a que completen un informe del VAERS.
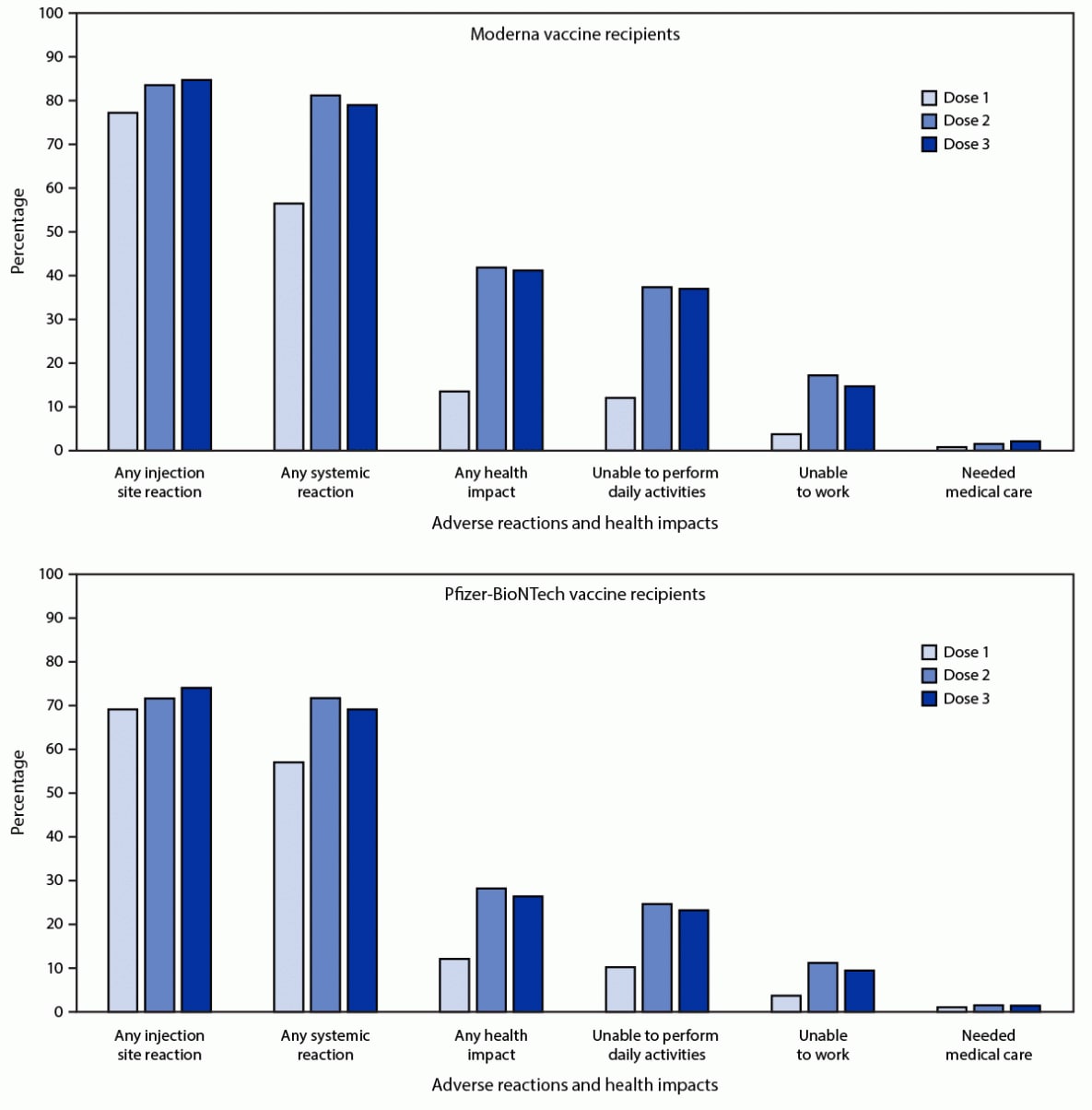
Entre los 21,658 solicitantes de registro v-safe que recibieron la misma vacuna de ARNm para las 3 dosis, 12,591 (58.1%) completaron al menos una encuesta de control de salud en los días 0 a 7 después de las 3 dosis; 79.4% y 74.1% informaron reacciones locales o sistémicas, respectivamente, después de la dosis 3, en comparación con 77.6% y 76.5% que informaron reacciones locales o sistémicas, respectivamente, después de la dosis 2. Entre los solicitantes de registro que recibieron 3 dosis de Moderna (6,283), Las reacciones se notificaron con más frecuencia después de la dosis 3 que la dosis 2 (5,323; 84.7% y 5,249; 83.5%; valor de p = 0.03) (Figura). Las reacciones sistémicas se notificaron con menos frecuencia después de la dosis 3 que la dosis 2 (4,963; 79.0% y 5,105; 81.3%; valor de p <0.001).
Entre los solicitantes de registro que recibieron 3 dosis de Pfizer-BioNTech (6,308), se notificaron reacciones locales con más frecuencia después de la dosis 3 que después de la dosis 2 (4,674; 74.1% y 4,523; 71.7%; valor de p <0.001). Las reacciones sistémicas se notificaron con menos frecuencia después de la dosis 3 que la dosis 2 (4,363; 69.2% y 4,524; 71.7%; valor de p <0.001). Entre los que informaron dolor después de la dosis 3 de una vacuna de ARNm, la mayoría de las reacciones fueron leves (4,909; 51.4%) o moderadas (4,000; 41.9%); 637 (6.7%) informaron dolor severo (definido como dolor que dificulta o imposibilita las actividades diarias).
Discusión
Al 19 de septiembre de 2021, aproximadamente 2.21 millones de personas en los Estados Unidos habían recibido dosis adicionales de vacunas COVID-19.† † después de completar una serie primaria. Desde el 12 de agosto hasta el 19 de septiembre de 2021, no se observaron patrones inesperados de reacciones adversas entre 22,191 solicitantes de registro v-safe que recibieron una dosis adicional de la vacuna COVID-19. La mayoría de las reacciones locales y sistémicas notificadas fueron de leves a moderadas, transitorias y se notificaron con mayor frecuencia al día siguiente de la vacunación. La mayoría de los solicitantes de registro que recibieron una dosis adicional informaron una serie de vacunación de ARNm primaria seguida de una tercera dosis del mismo fabricante.
El ensayo clínico Pfizer-BioNTech, que incluyó a 306 personas de entre 18 y 55 años, mostró que las reacciones después de la dosis 3 eran comparables a las notificadas después de la dosis 2 (3). Sin embargo, este análisis de los datos de v-safe encontró que las reacciones locales eran un poco más comunes y las reacciones sistémicas menos comunes después de la dosis 3 de Pfizer-BioNTech.
Los patrones de reacciones adversas observados después de la dosis 3 de la vacuna Moderna o Pfizer-BioNTech fueron consistentes con las reacciones descritas anteriormente después de recibir la dosis 2
El número de solicitantes de registro que indicaron que recibieron 2 dosis de la vacuna Janssen o recibieron su dosis adicional de un fabricante diferente al de su serie primaria fue pequeño, lo que limita las conclusiones.
Los datos sobre la seguridad o eficacia de la vacunación con productos de la vacuna COVID-19 de diferentes fabricantes son limitados; el Comité Asesor sobre Prácticas de Inmunización (ACIP) recomienda que las personas con afecciones inmunodeprimidas de moderada a grave reciban una tercera dosis de la vacuna de ARNm COVID-19 del mismo fabricante que la serie primaria.
Actualmente, las recomendaciones de los CDC para una dosis adicional no incluyen a las personas que recibieron la vacuna Janssen.
Durante el período cubierto por este estudio, las recomendaciones del ACIP para una dosis adicional de la vacuna COVID-19 se limitaron a personas con afecciones inmunodeficientes de moderada a grave que habían recibido
2 dosis de una vacuna de ARNm.
Un estudio realizado entre pacientes de hemodiálisis inmunodeprimidos informó que las reacciones locales y sistémicas después de la dosis 3 de la vacuna Pfizer-BioNTech fueron similares a las de la dosis 2.¶¶ Los informes recientes de infecciones en personas vacunadas y aumentos en la prevalencia de la infección con la variante B.1.617.2 (Delta) del SARS-CoV-2, el virus que causa el COVID-19, entre las personas vacunadas podrían haber llevado a algunas personas a buscar una dosis adicional fuera de las recomendaciones. La mediana del intervalo desde la finalización de la serie primaria hasta la recepción de una dosis adicional fue de aproximadamente 6 meses; por lo tanto, las personas priorizadas durante la implementación de las vacunas contra el COVID-19, incluidos los trabajadores de la salud y los adultos mayores, podrían haber recibido una dosis adicional.
Los hallazgos de este informe están sujetos a al menos cuatro limitaciones. En primer lugar, la inscripción en v-safe es voluntaria y probablemente no sea representativa de la población vacunada de EE. UU. la mayoría de los participantes se identificaron como blancos y no hispanos. En segundo lugar, durante este período de estudio, las recomendaciones de dosis adicionales se limitaron a personas con afecciones inmunodeficientes que completaron una serie de vacunación primaria de ARNm COVID-19; sin embargo, v-safe no incluye información sobre el estado inmunológico.
Los receptores de dosis adicionales probablemente incluyen personas con y sin condiciones inmunodeprimidas. En tercer lugar, no se puede establecer una relación causal entre una vacuna y un evento adverso clínicamente grave informado después de la vacunación utilizando datos de v-safe. Por último, no se disponía de datos suficientes para determinar los patrones de reacciones adversas después de recibir una dosis adicional de un fabricante diferente de la serie primaria o para la vacuna Janssen.
Se recomienda una dosis adicional de la vacuna de ARNm COVID-19 para personas con afecciones inmunodeprimidas de moderada a grave (5).
Los CDC recomendaron una dosis adicional de la vacuna Pfizer-BioNTech ≥6 meses después de completar la serie de vacunas primarias entre personas ≥65 años, residentes en entornos de atención a largo plazo y personas de 50 a 64 años con afecciones médicas subyacentes; Las personas de 18 a 49 años con afecciones médicas subyacentes y las personas de 18 a 64 años con mayor riesgo de exposición y transmisión de COVID-19 debido a un entorno ocupacional o institucional pueden recibir una dosis adicional según sus beneficios y riesgos individuales.
Los análisis iniciales de los datos de seguridad de> 22,000 solicitantes de registro v-safe muestran que las reacciones locales aumentan ligeramente y las reacciones sistémicas disminuyen ligeramente después de la dosis 3 de un ARNm que después de la dosis 2.
No se identificaron patrones inesperados de reacciones adversas; los reportados fueron de leves a moderados y transitorios. Los CDC continuarán monitoreando la seguridad de dosis adicionales de la vacuna COVID-19. Los datos adicionales sobre las reacciones adversas asociadas con diferentes combinaciones de vacunas y el tiempo transcurrido desde la finalización de la serie primaria serán importantes para orientar las recomendaciones de salud pública.
| Característica | Moderna,%† (n = 10,601) | Pfizer-BioNTech,%† (n = 11,412) | Janssen,%†, § (n = 178) | Total (N = 22,191) | ||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Dosis 3 Moderna (n = 10,453; 98.6%) | Dosis 3 Pfizer-BioNTech (n = 144; 1.4%) | Dosis 3 Janssen (n = 4; 0.04%) | Dosis 3 Pfizer-BioNTech (n = 11,209; 98.2%) | Dosis 3 Moderna (n = 197; 1.7%) | Dosis 3 Janssen (n = 6; 0.1%) | Dosis 2 Janssen (n = 48; 27.0%) | Dosis 2 Moderna (n = 64; 36.0%) | Dosis 2 Pfizer-BioNTech (n = 66; 37.1%) | ||
| Sexo | ||||||||||
| Femenino | 63.8 | 63.9 | 50.0 | 63.0 | 63.5 | 33.3 | 39.6 | 57.8 | 59.1 | 63.3 |
| Masculino | 35.1 | 34.0 | 50.0 | 36.1 | 36.0 | 66.7 | 60.4 | 42.2 | 40.9 | 35.7 |
| Desconocido | 1.0 | 2.1 | 0 | 0.9 | 0.5 | 0 | 0 | 0 | 0 | 1.0 |
| Grupo de edad, años | ||||||||||
| 0-17 | 0.0 | 0.7 | 0.0 | 0.6 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.3 |
| 18-49 | 25.7 | 36.1 | 25.0 | 31.5 | 42.6 | 50.0 | 54.2 | 60.9 | 57.6 | 29.1 |
| 50-64 | 28.4 | 27.1 | 50.0 | 31.1 | 29.9 | 0.0 | 33.3 | 34.3 | 30.3 | 29.8 |
| 65-74 | 33.9 | 27.1 | 0.0 | 27.8 | 21.3 | 50.0 | 10.4 | 4.7 | 9.1 | 30.5 |
| 75-84 | 10.9 | 9.0 | 25.0 | 8.3 | 5.6 | 0.0 | 2.1 | 0.0 | 3.0 | 9.5 |
| ≥ 85 | 1.1 | 0.0 | 0.0 | 0.7 | 0.5 | 0.0 | 0.0 | 0.0 | 0.0 | 0.9 |
| Etnia | ||||||||||
| Hispano | 8.0 | 15.3 | 0 | 8.2 | 5.6 | 0 | 25.0 | 6.3 | 10.6 | 8.2 |
| No hispano / latino | 87.7 | 81.9 | 100 | 87.6 | 90.9 | 100 | 54.2 | 89.1 | 89.4 | 87.6 |
| Desconocido | 4.3 | 2.8 | 0 | 4.2 | 3.6 | 0 | 20.8 | 4.7 | 0 | 4.2 |
| Carrera | ||||||||||
| AI / AN | 0.5 | 0.7 | 0 | 0.5 | 0.5 | 0 | 2.1 | 0 | 0 | 0.5 |
| Asiático | 4.9 | 5.6 | 0 | 6.1 | 7.1 | 0 | 2.1 | 14.1 | 13.6 | 5.6 |
| Negro | 5.6 | 3.5 | 0 | 6.2 | 1.5 | 16.7 | 6.3 | 6.3 | 9.1 | 5.9 |
| NHPI | 0.2 | 0 | 0 | 0.3 | 0.5 | 0 | 4.2 | 0 | 0 | 0.3 |
| Blanco | 82.6 | 82.6 | 100 | 80.4 | 85.8 | 66.7 | 56.3 | 71.9 | 69.7 | 81.4 |
| Multirracial | 1.9 | 2.1 | 0 | 1.8 | 1.5 | 16.7 | 4.2 | 4.7 | 3.0 | 1.9 |
| Otro | 2.1 | 4.2 | 0 | 2.1 | 0.5 | 0 | 6.3 | 1.6 | 3.0 | 2.1 |
| Desconocido | 2.3 | 1.4 | 0 | 2.5 | 2.5 | 0 | 18.8 | 1.6 | 1.5 | 2.4 |
abreviaturas: AI / AN = indio americano / nativo de Alaska; NHPI = Nativo de Hawái o de otras islas del Pacífico.
* Porcentaje de solicitantes de registro que completaron al menos una encuesta de control de salud v-safe en los días 0 a 7 después de la vacunación.
† Serie de vacunación primaria.
§ Incluye a las personas que recibieron una dosis única primaria de Janssen y 1 dosis adicional de vacuna de los fabricantes enumerados.
| Reacción | Moderna,%† (n = 10,477) | Pfizer-BioNTech,%† (n = 11,284) | Janssen,%†, § (n = 174) | Total (N = 22,191) | ||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Dosis 3 Moderna (n = 10,453; 98.6%) | Dosis 3 Pfizer-BioNTech (n = 144; 1.4%) | Dosis 3 Janssen (n = 4; 0.04%) | Dosis 3 Pfizer-BioNTech (n = 11,209; 98.2%) | Dosis 3 Moderna (n = 197; 1.7%) | Dosis 3 Janssen (n = 6; 0.1%) | Dosis 2 Janssen (n = 48; 27.0%) | Dosis 2 Moderna (n = 64; 36.0%) | Dosis 2 Pfizer-BioNTech (n = 66; 37.1%) | ||
| Días desde la serie primaria, mediana (IQR) | 182 (164 – 198) | 183 (161 – 204) | 173 (141 – 182) | 183 (157 – 209) | 186 (161 – 217) | 123 (113 – 182) | 84 (16 – 136) | 156 (140 – 164) | 150 (136 – 167) | 182 (160 – 202) |
| Cualquier reacción en el lugar de la inyección | 80.9 | 64.6 | 75.0 | 69.4 | 81.7 | 83.3 | 25.0 | 70.3 | 80.3 | 74.9 |
| Picor | 20.0 | 11.8 | 0 | 8.4 | 10.2 | 16.7 | 10.4 | 6.3 | 7.6 | 13.9 |
| Dolor | 75.9 | 60.4 | 75.0 | 66.6 | 80.2 | 83.3 | 20.8 | 68.8 | 74.2 | 71.0 |
| Enrojecimiento | 25.2 | 8.3 | 0 | 9.8 | 20.8 | 16.7 | 6.3 | 7.8 | 12.1 | 17.1 |
| Hinchazón | 33.6 | 17.4 | 0 | 16.8 | 30.5 | 16.7 | 6.3 | 12.5 | 18.2 | 24.8 |
| Cualquier reacción sistémica | 75.2 | 59.7 | 50.0 | 65.1 | 76.1 | 100 | 31.3 | 68.8 | 63.6 | 69.9 |
| El dolor abdominal | 8.4 | 3.5 | 0 | 6.4 | 8.1 | 16.7 | 4.2 | 3.1 | 6.1 | 7.3 |
| Mialgia | 49.8 | 29.2 | 0 | 36.3 | 49.2 | 50.0 | 20.8 | 45.3 | 33.3 | 42.7 |
| Escalofríos | 31.3 | 8.3 | 50.0 | 17.5 | 33.5 | 50.0 | 8.3 | 23.4 | 10.6 | 24.1 |
| Diarrea | 9.9 | 7.6 | 0 | 9.0 | 9.6 | 16.7 | 8.3 | 6.3 | 9.1 | 9.4 |
| Fatiga | 61.8 | 44.4 | 0 | 51.0 | 60.9 | 83.3 | 14.6 | 48.4 | 50.0 | 56.0 |
| Fiebre | 36.4 | 20.1 | 50.0 | 22.2 | 37.1 | 50.0 | 6.3 | 37.5 | 12.1 | 29.0 |
| Dolor de cabeza | 49.0 | 31.1 | 0 | 38.4 | 49.7 | 83.3 | 18.8 | 35.9 | 40.9 | 43.4 |
| Dolor en las articulaciones | 33.0 | 18.8 | 0 | 23.0 | 31.0 | 33.3 | 16.7 | 20.3 | 19.7 | 27.7 |
| Náuseas | 18.8 | 10.4 | 25.0 | 13.6 | 21.3 | 33.3 | 8.3 | 9.4 | 18.2 | 16.1 |
| Erupción | 2.3 | 0.7 | 0 | 1.9 | 2.5 | 0 | 4.2 | 1.6 | 1.5 | 2.1 |
| Vómitos | 2.2 | 2.1 | 25.0 | 1.4 | 2.0 | 0 | 2.1 | 0 | 0 | 1.7 |
| Cualquier impacto en la salud | 39.2 | 19.4 | 0 | 25.2 | 39.1 | 33.3 | 16.7 | 28.1 | 24.2 | 31.8 |
| Incapaz de realizar las actividades diarias normales | 35.2 | 18.1 | 0 | 22.1 | 33.0 | 33.3 | 10.4 | 25.0 | 15.2 | 28.3 |
| Incapaz de trabajar o asistir a la escuela | 13.7 | 4.9 | 0 | 9.0 | 21.3 | 16.7 | 10.4 | 6.3 | 13.6 | 11.3 |
| Atención médica necesaria | 2.1 | 1.4 | 0 | 1.5 | 3.0 | 0 | 6.3 | 0 | 0 | 1.8 |
| Telesalud | 0.9 | 0.7 | 0 | 0.7 | 1.0 | 0 | 2.1 | 0 | 0 | 0.8 |
| Clínicas | 0.7 | 0.7 | 0 | 0.6 | 0.5 | 0 | 4.2 | 0 | 0 | 0.6 |
| Visita de emergencia | 0.2 | 0 | 0 | 0.2 | 0 | 0 | 4.2 | 0 | 0 | 0.2 |
| Hospitalización | 0.05 | 0 | 0 | 0.1 | 0 | 0 | 0 | 0 | 0 | 0.1 |
FIGURA. Reacciones adversas e impactos en la salud informados por personas que recibieron 3 dosis * de la vacuna COVID-6,283 Moderna (N = 6,308) o Pfizer-BioNTech (N = 19) y completaron al menos una encuesta de control de salud v-safe en los días 0– 7 después de cada dosis, por número de dosis: Estados Unidos, del 12 de agosto al 19 de septiembre de 2021